【新単元】ダニエル電池について理解しよう!【来年出るかも!?】
こんにちは。郷中塾の平です。
昨年から学習指導要領の改定に伴い、3年の理科に「金属のイオンへのなりやすさ」「ダニエル電池」があらたに加わりました。

2022年度入試で出題されなかった県では、次年度の出題可能性に備えて他県の出題形式を見ておくのが良いでしょう。
1.ダニエル電池の仕組み
ダニエル電池の仕組みを理解するためには、『イオンの仕組み』と『ボルタ電池』について理解する必要があります。
まずは簡単な『イオンの仕組み』について確認してみましょう。
1-1.イオンの仕組み
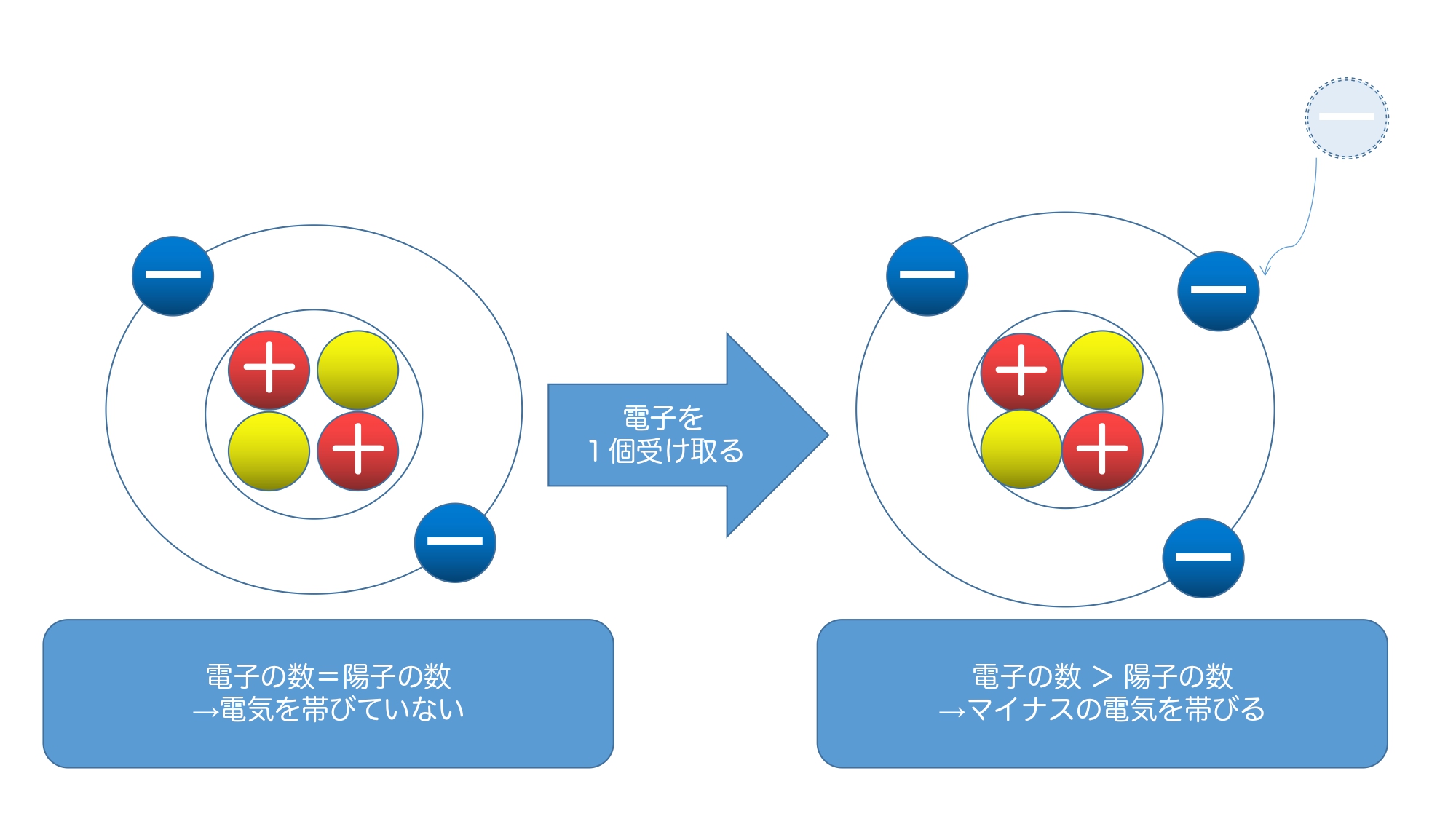
イオンについて考える際に必要なのは「原子の構造」です。
原子は次のような構造をしています。
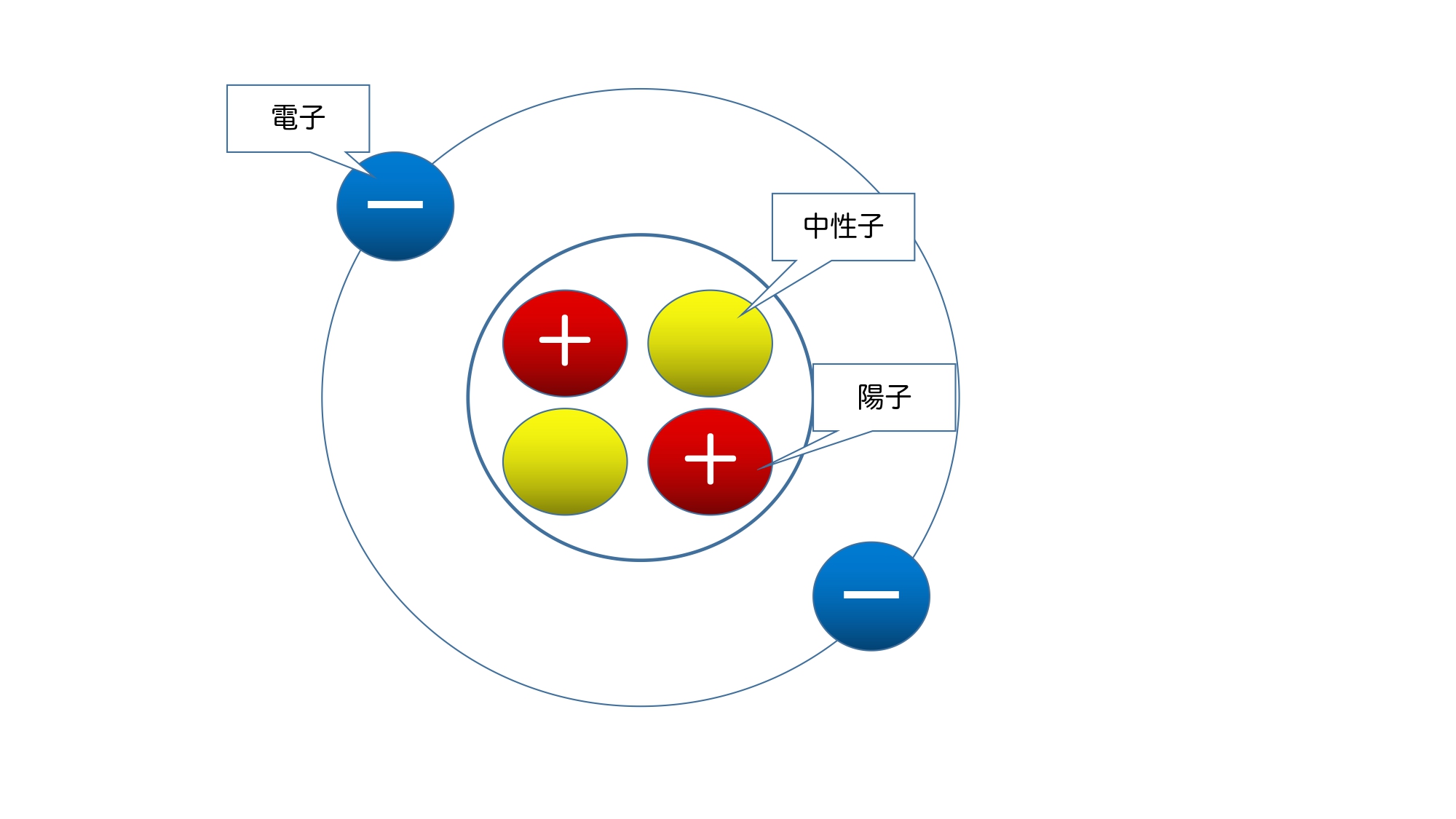
簡単にいうと「陽子」が「+」で「電子」が「−」であり、これらの数が一致する(陽子の数=電子の数)ことで原子は電気を帯びていません。
つまり、「陽子の数」、あるいは「電子の数」のどちらが多くなると電気を帯びることになります。
ここで大事なのは『移動するのは「電子」だけである』という部分です。

陽イオンと陰イオンについてまとめると以下のようになります。
電子を失うと、全体では陽子の数が多くなるため、プラスとなります。
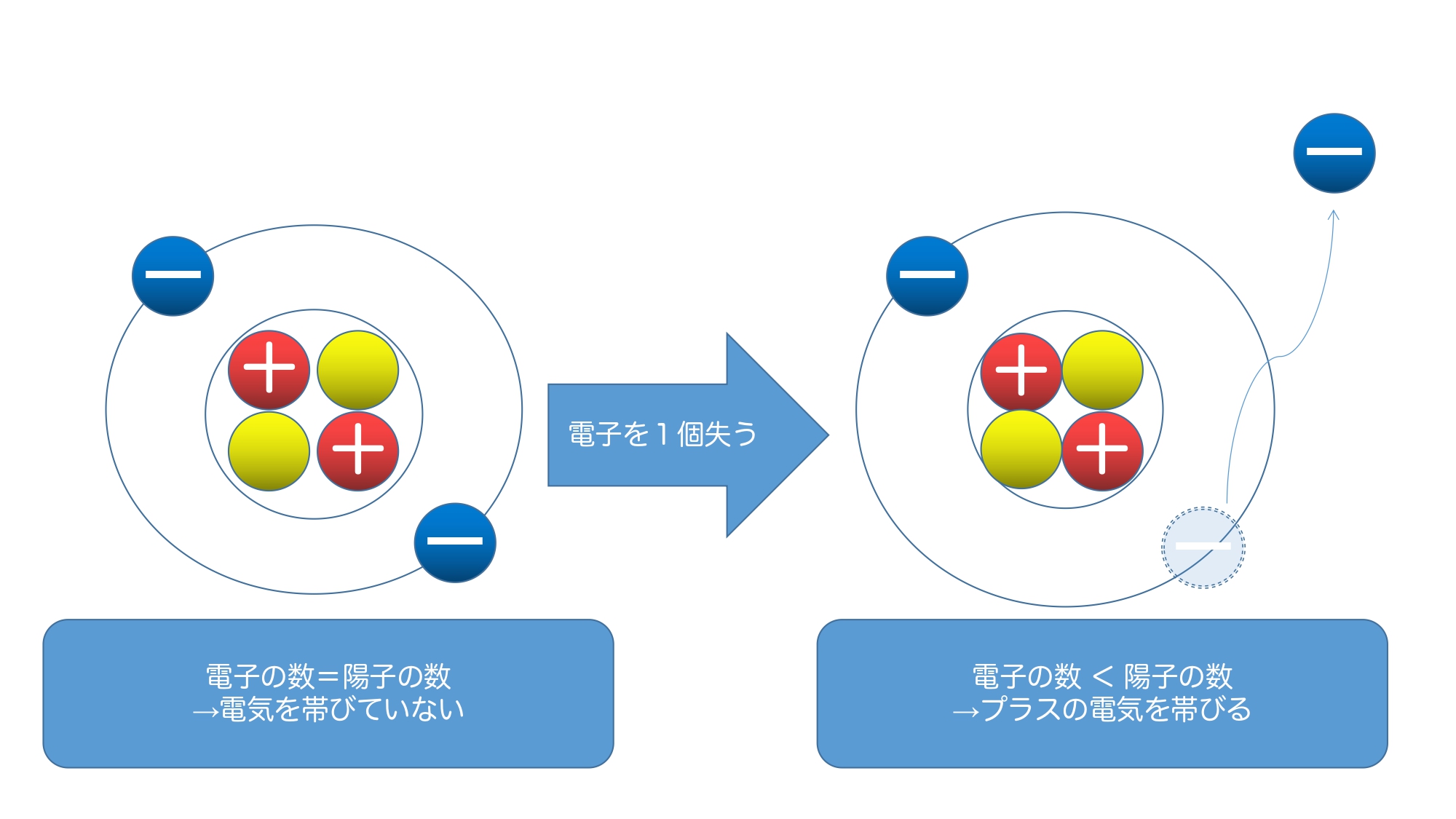
電子を受け取ると、全体では電子の数が多くなるため、マイナスとなります。

1-2.イオン化傾向
陽イオン、陰イオンにどのようにしてなるのかは前述の通りですが、「金属のイオンへのなりやすさ(イオン化傾向)」についても触れておきます。
中学理科の範囲についてはイオン化傾向を覚えることが必須とされていないため、実験の結果から「どの金属がイオンになりやすいか」を判断する問題が出題されます。
よく出てくる実験としては
「金属イオンを含む水溶液が入った試験管に、(異なる種類の)金属板を入れて反応を見る」
というものです。
イオン化傾向が大きい方がイオンになりやすいため、水溶液中の金属イオンよりイオン化傾向の大きい金属イオンを含む金属板を入れると、金属板が溶け出します。
硫酸銅水溶液に亜鉛板を入れたものを使って考えてみると
次のような図になります。
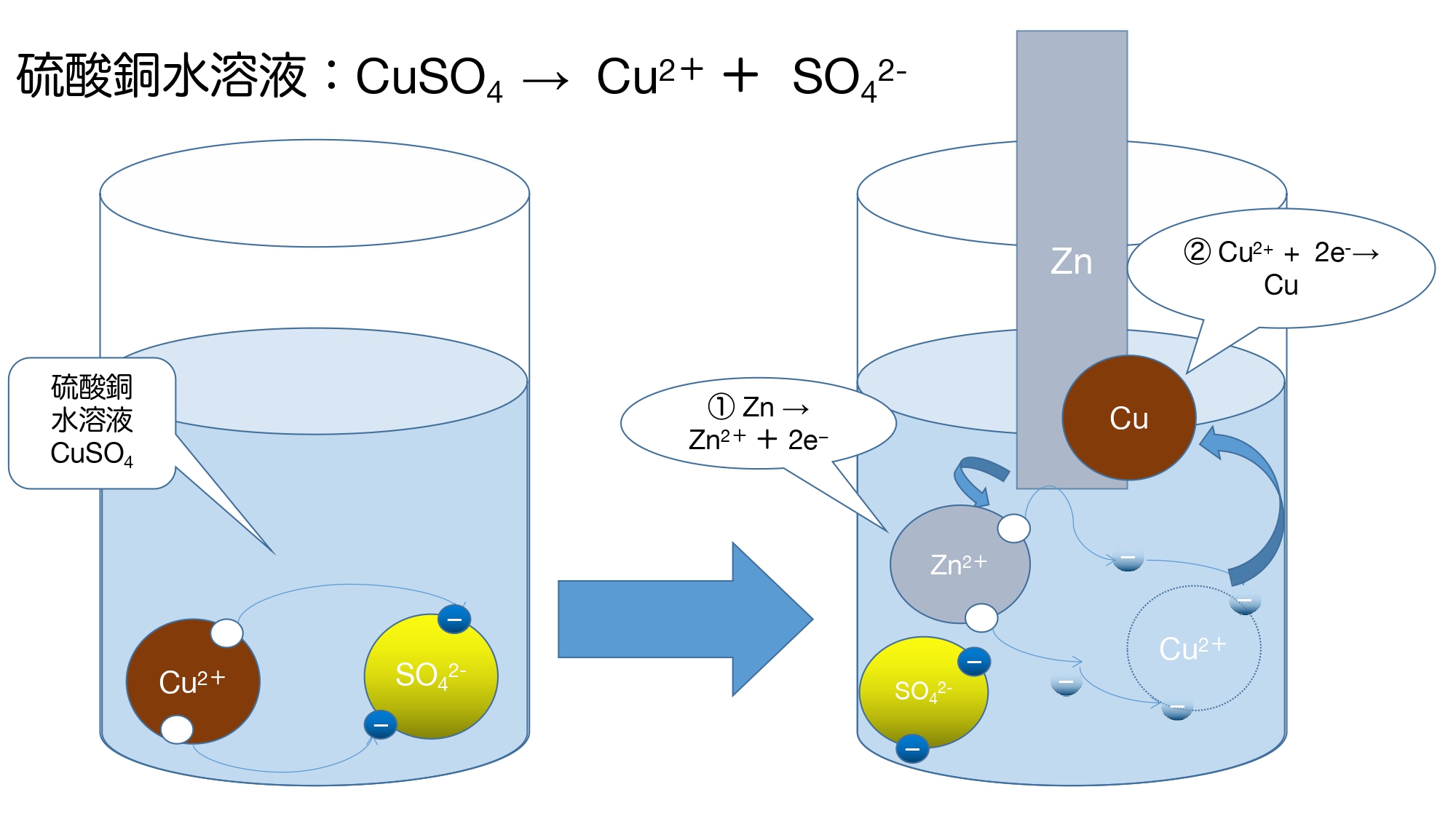
元々水溶液中には銅イオンがあります。
しかし、そこに亜鉛板を入れるとイオン化傾向が
亜鉛 (Zn) > 銅 (Cu)
であるために電子(e–)の受け渡しを行って
①亜鉛が電子を2つ放出して亜鉛イオンになるため亜鉛板が溶け出す。
Zn → Zn2+ + 2e−
②銅イオンが電子を2つ受け取って銅原子として亜鉛板状に析出する。
Cu2+ + 2e–→ Cu
という化学変化が起こります。
これは 入れた金属のイオン化傾向 > 水溶液中の金属のイオン化傾向 であるために起こる反応であり、
水溶液中の金属のイオン化傾向 > 入れた金属のイオン化傾向であれば何も変化は起きません。
水溶液中の金属の種類と入れた金属の種類が同じ場合も同様です。
イオン化傾向の順番を覚えているか確認をする問題は出題されませんが、テスト時の時間短縮や、考え方があっているかの確認のために語呂合わせを使って覚えてしまっても良いでしょう。
1-3.ボルタ電池
次にボルタ電池について説明します。
電池というのは「イオン化傾向と電解質中のイオン(電子)を利用して、電子の移動すなわち電流を発生させる装置」になります。


中でも、電解質として硫酸(あるいは塩酸)、金属に亜鉛と銅を利用しているものを「ボルタ電池」と呼びます。
ダニエル電池との違いとして重要なのは「電解質の水溶液が一種類である」というところです。
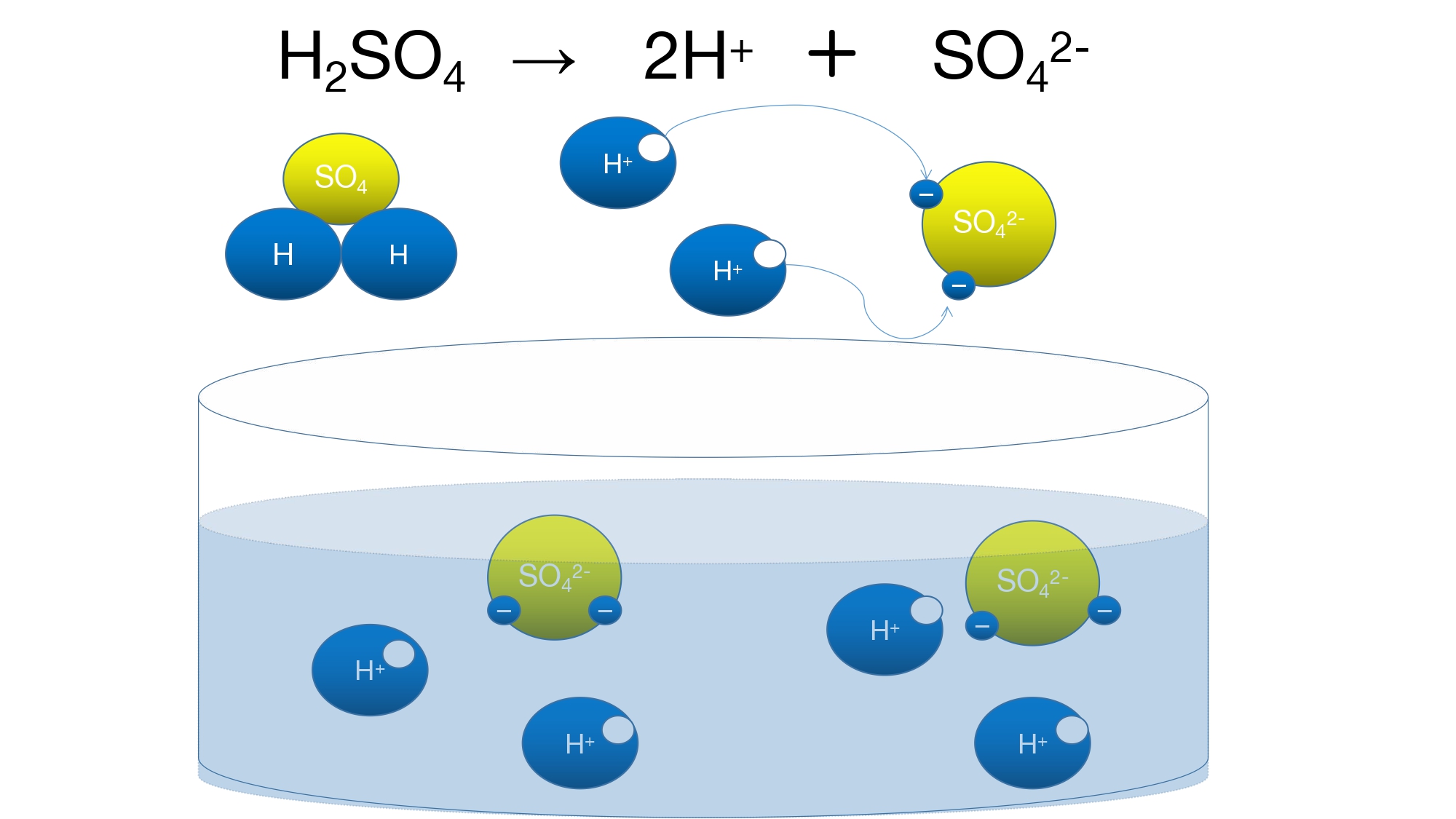
硫酸の電離は図のようになり、水溶液中には水素イオン(H+)と硫酸イオン(S042-)が存在します。
ここに、亜鉛板と銅板を入れると
亜鉛板→溶け出す
銅板→水素(の泡)がくっつく
という変化が起こります。
順に考えると
①銅と亜鉛では亜鉛の方がイオン化傾向が大きいので、亜鉛が亜鉛イオンとして水溶液中に溶け出す。
②亜鉛イオンが放出した電子が導線を通って銅板側に移動していく。
③銅板の表面まできた電子が水溶液中の水素イオンと結びつき、水素原子となり、水素原子が二つ結びついて水素分子(H2)となる。
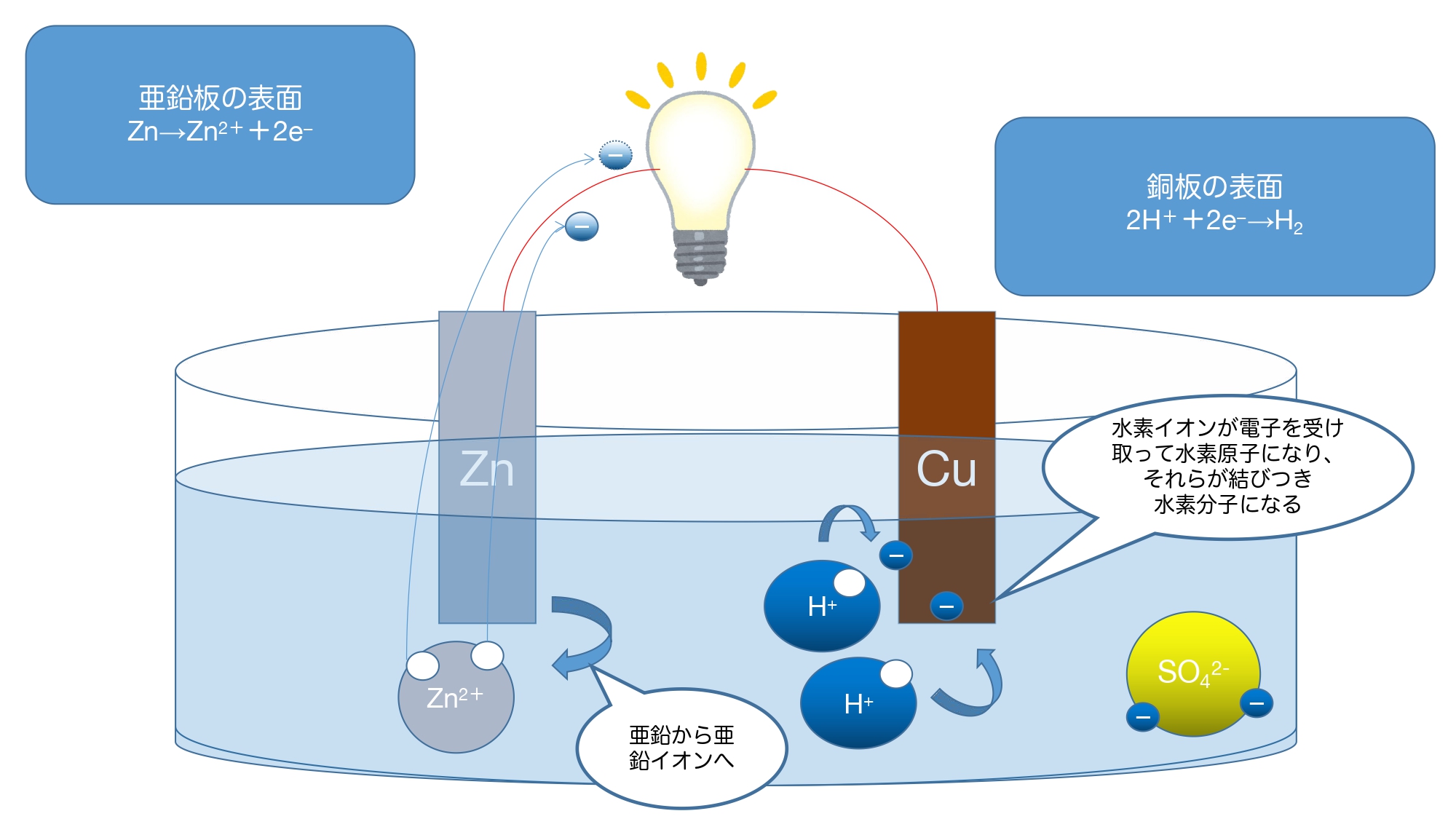
②の過程で豆電球が光り、これが電池の仕組みになっています。
テストで問われることが多いのは以下の内容になります。
A.亜鉛板から銅板。
Q.どちらが+極(−極)か?
A.電子と電流の向きは逆であるため、電子が向かっていく銅板が+極。
Q.亜鉛板と銅板の表面で起こる変化は?
A.亜鉛板の表面:Zn → Zn2+ + 2e−
銅板の表面:2H+ + 2e−→ H2

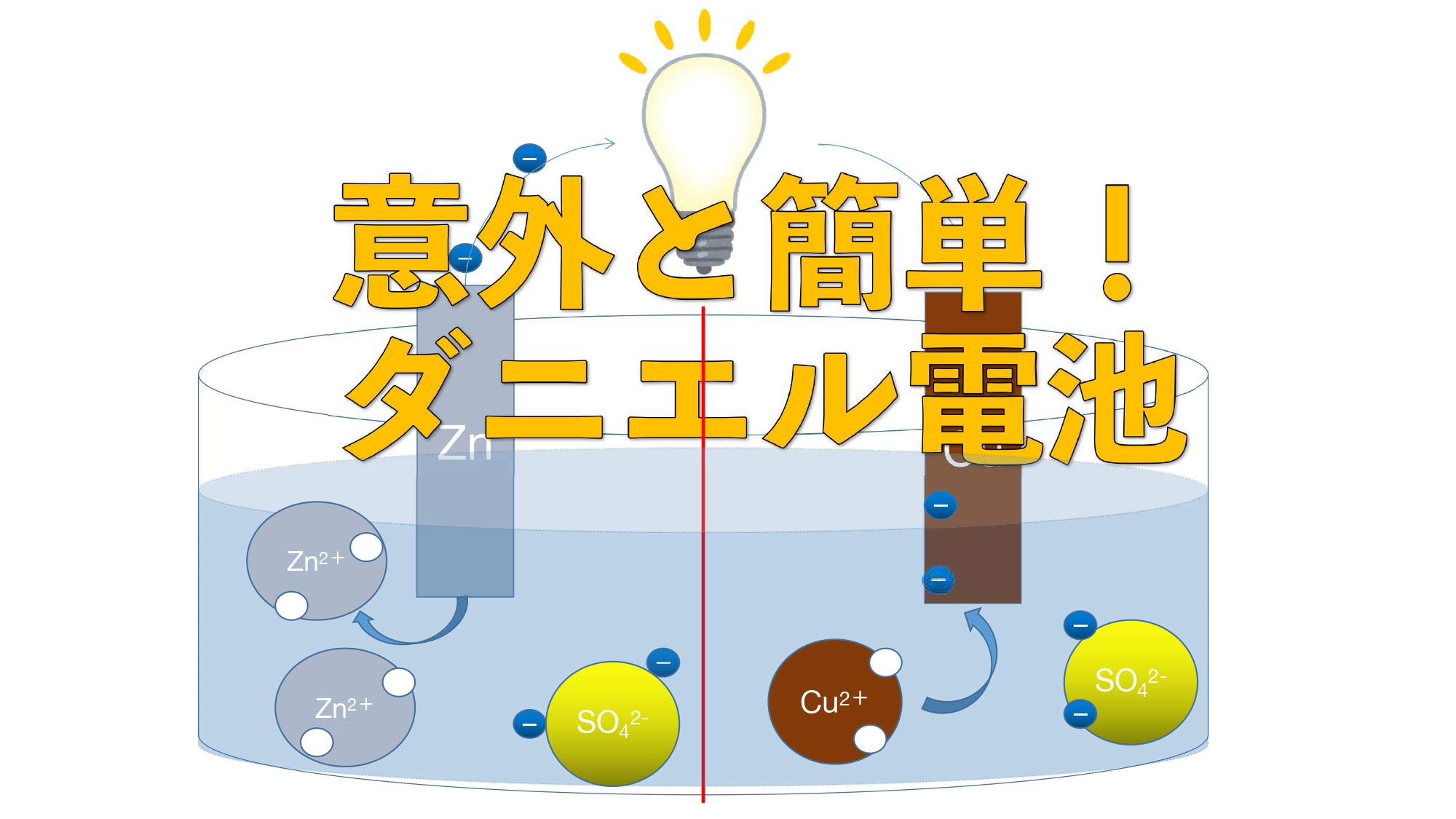
1-4.ダニエル電池
本題のダニエル電池です。
ボルタ電池には「銅板の表面に水素が発生し、銅板の表面で電子の受け渡しが行われなくなる」という欠点がありました。
そのため、改良されたものがダニエル電池です。

材料は金属板として「亜鉛板」「銅板」、水溶液として「硫酸亜鉛水溶液」「硫酸銅水溶液」を用います。
まず、硫酸亜鉛水溶液と硫酸銅水溶液の電離は以下のようになります。
これらは問われることはないので参考程度で構いません。
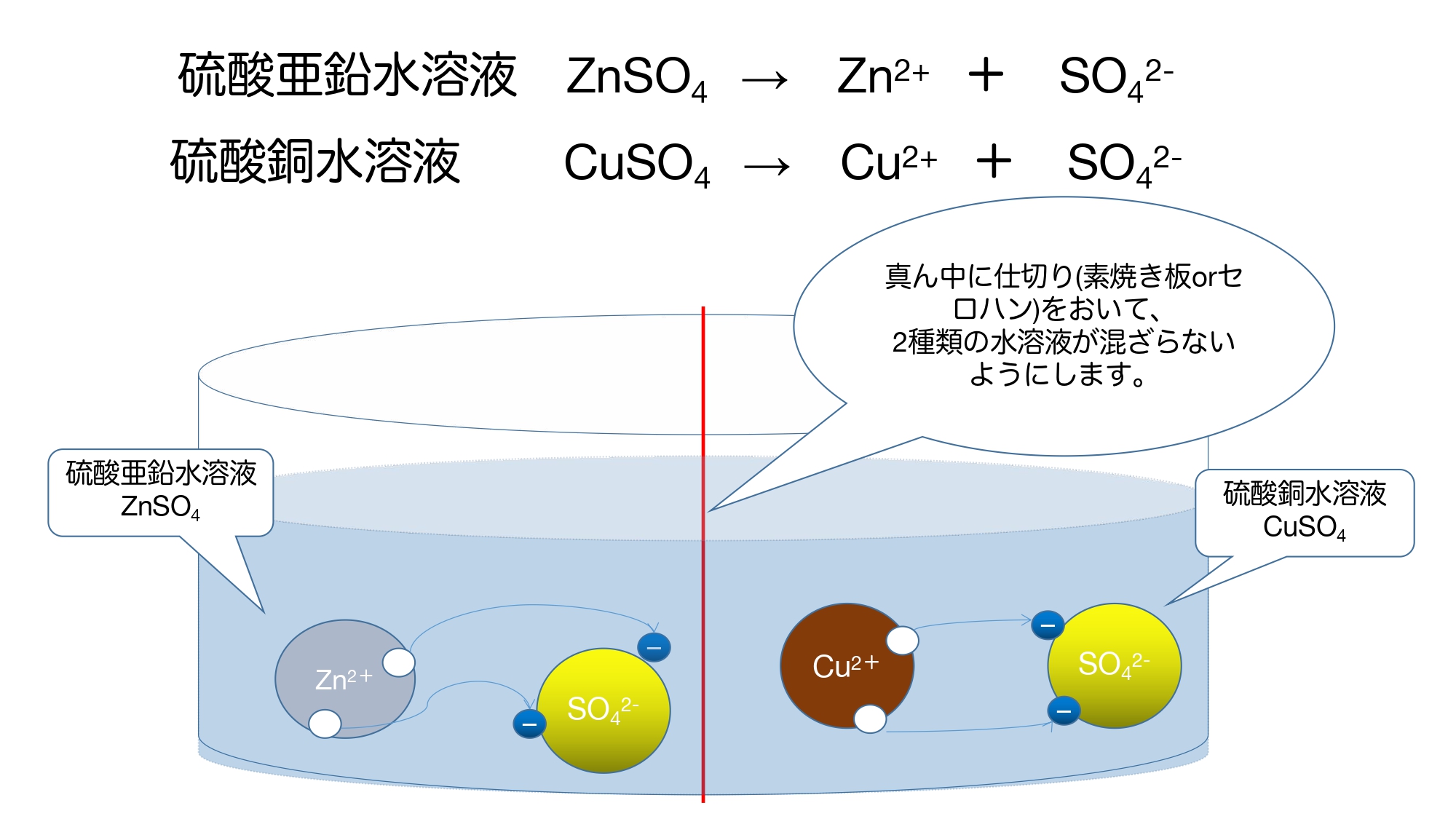
ボルタ電池では1種類の水溶液だったのに対し、ダニエル電池は2種類の水溶液を用いるため、水溶液を仕切り板(素焼き板orセロハン)で分けます。
仕切りの役割としては
・各水溶液の電気の偏りをなくす
の2つがあります。
2点目についてはもう少し詳しく説明します。
反応が進むと、硫酸亜鉛水溶液中には亜鉛イオンがどんどん増え、硫酸銅水溶液からは銅イオンがどんどん減少していきます。
そうなってしまうと硫酸銅水溶液の中には硫酸イオン(陰イオン)しか残らないため、マイナスの電子と退きあい、移動しづらくなります。
そこで、硫酸亜鉛側に硫酸イオン(陰イオン)、硫酸銅側に亜鉛イオン(陽イオン)を移動させることでバランスを保つのです。
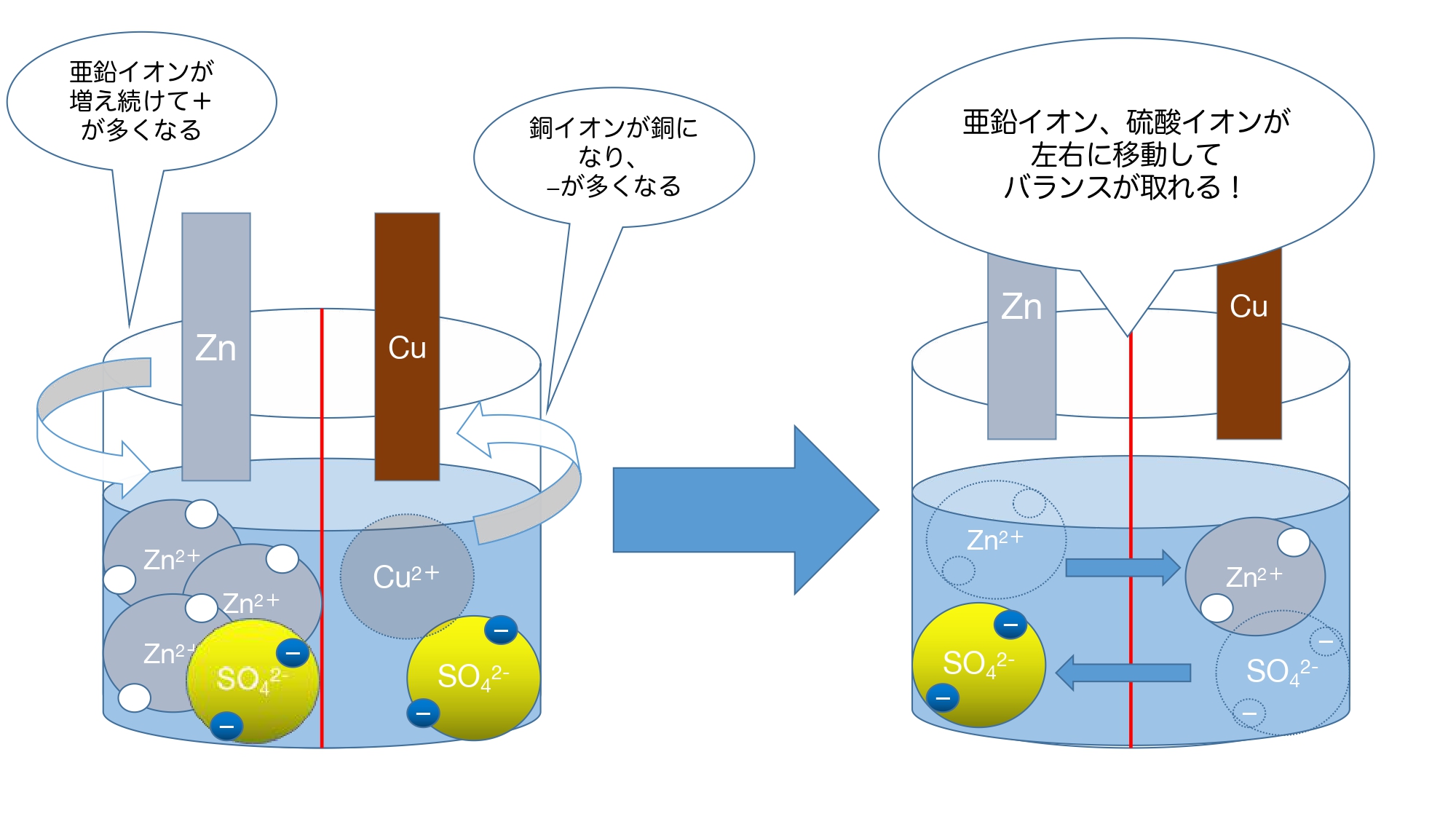
電子の移動の(電流が流れる)過程としてはボルタ電池と変わりません。
①銅と亜鉛では亜鉛の方がイオン化傾向が大きいので亜鉛が亜鉛イオンとして水溶液中に溶け出す。
②亜鉛イオンが放出した電子が導線を通って銅板側に移動していく。
次が違います。
③銅板の表面まできた電子が水溶液中の銅イオンと結びつき、銅原子(Cu)となり、銅板上に付着(析出)する。
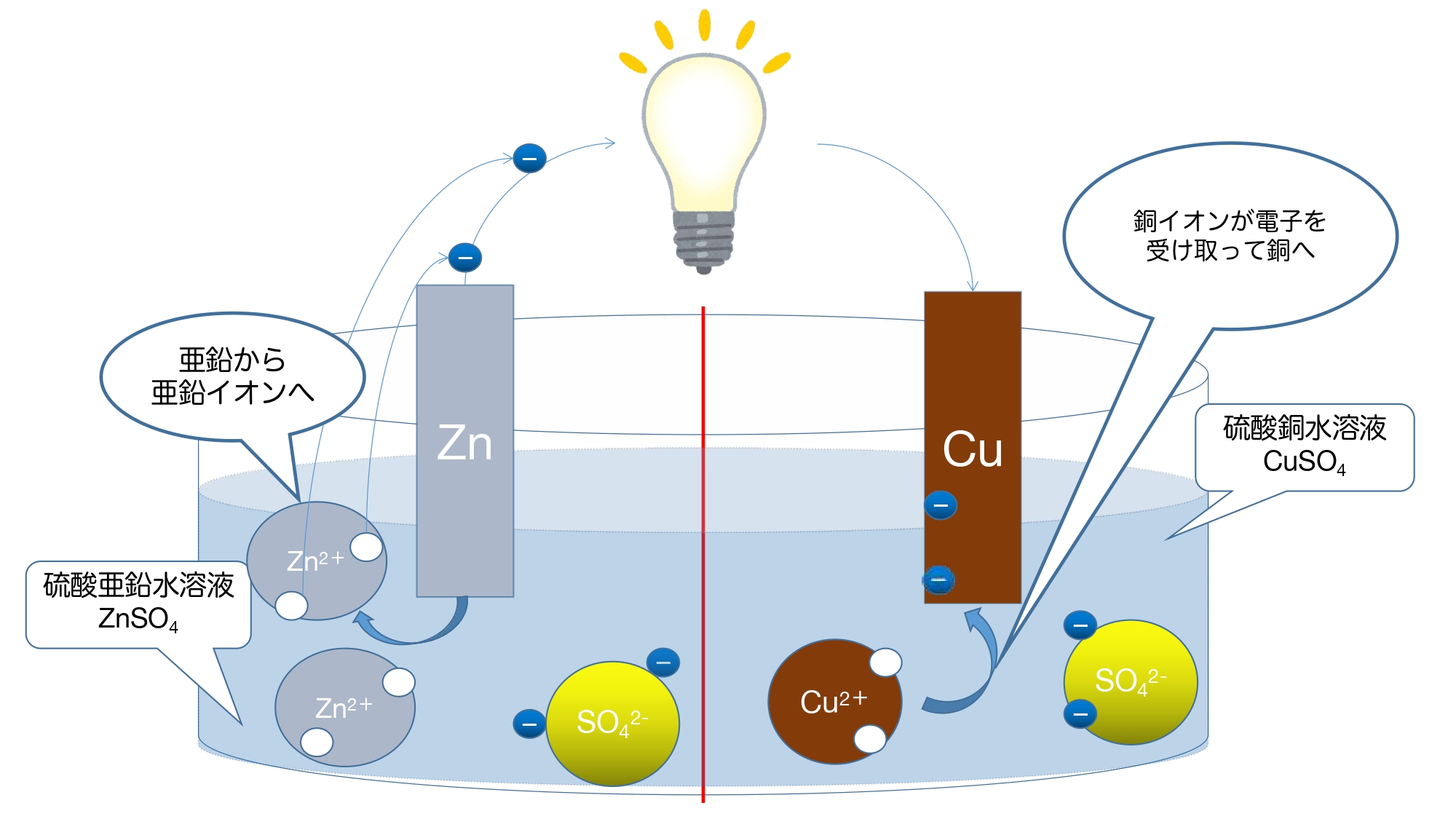
ダニエル電池に関してテストで問われること多いのは、ボルタ電池と同じく「電子の移動の向き」や「どちらが+極、−極か」という部分に加えて、ボルタ電池と異なる「金属板の表面で起こる変化」や「素焼き板の役割」などです。

2.出題都府県
出題都府県については前述の通り、19都府県となりました。
出題内容と配点比率等については表の通りになります。
| 都道府県名 | 大問番号 | 配点比率 | ボルタ電池 | ダニエル電池 | イオン化傾向 | 備考 |
|---|---|---|---|---|---|---|
| 宮城県 | 3 | 18% | ○ | |||
| 群馬県 | 4 | 21% | ○ | ○ | ○ | セロハンの役割 |
| 埼玉県 | 1 | 3% | ○ | 小問集合 | ||
| 千葉県 | 9 | 12% | ○ | ○ | ||
| 東京都 | 5 | 8% | ○ | |||
| 神奈川県 | 6 | 16% | ○ | ○ | ||
| 富山県 | 3 | 2問 | ○ | |||
| 福井県 | 6 | 12% | ○ | ○ | ||
| 愛知県 | 6 | 22点中1点 | ○ | |||
| 三重県 | 6 | 16% | ○ | ○ | 素焼きの役割 | |
| 京都府 | 2 | 10% | ○ | 素焼きの役割 | ||
| 和歌山県 | 4 | 10% | ○ | セロハンの役割 | ||
| 鳥取県 | 6 | 14% | ○ | ○ | ||
| 広島県 | 2 | 24% | ○ | ○ | 配点比率大 | |
| 愛媛県 | 2 | 5問 | ○ | ○ | セロハンの役割 | |
| 高知県 | 4 | 16% | ○ | ○ | セロハンの役割 | |
| 福岡県 | 4 | 60点中8点 | ○ | |||
| 長崎県 | 7 | 13% | ○ | ○ | ||
| 大分県 | 2 | 60点中4点 | ○ |
※配点比率が整数値にならない県については実数値、配点が公開されていない県については問題数を記載しています。
ダニエル電池についてはイオン化傾向を理解した上ので出題となりますので、両方が出題された県が多く見られました。
また、6県については「ダニエル電池の仕切りの役割を答えさせる問題」が出題されました。
初年度ということもあり基本問題が多かったですが、広島県の問題ではイオン化傾向の差によって電池の電圧が変わることに触れるものもありました。

3.鹿児島県はどうなる?
鹿児島は昨年は「金属のイオンへのなりやすさ」「ダニエル電池」からの出題はありませんでした。
過去5年の鹿児島県のイオンに関する問題の出題事例を確認しておきます。
| 出題番号 | 出題内容 | 配点 | |
|---|---|---|---|
| 2022年 | 大問5 Ⅰ1~4 | 塩化銅と塩酸の電気分解 | 8点 |
| 2021年 | 大問2 Ⅱ 1~4 | 塩酸と水酸化ナトリウムの中和反応 | 9点 |
| 2020年 | 大問3 Ⅰ 1 | 塩化ナトリウムの電離モデル | 2点 |
| 2019年 | 大問4 Ⅰ 1~3 | 酸とアルカリ | 6点 |
| 2018年 | 大問3 Ⅱ 1~3 | 塩化銅の電気分解 | 8点 |
表を見ていただければ分かるように、90点満点という配点の中でイオンの範囲はかなりのウエイトを占めています。
断定的なことは言えませんが、イオンの単元からの出題比率が高いことと、昨年出題されなかったことからすると、しっかりと対策して備えておいた方が良いでしょう。
4.終わりに
今回は「ダニエル電池」についてお話ししました。

一つずつ苦手を減らして入試本番に備えましょう!